1. Nguồn gốc
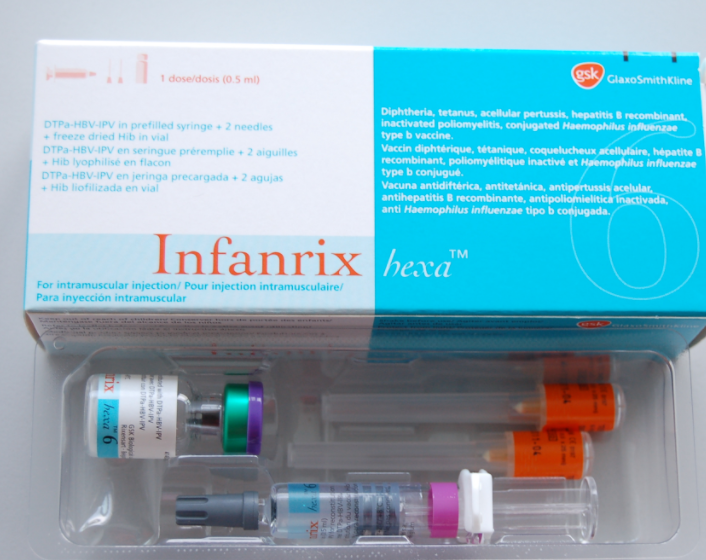
Vắc xin Infanrix hexa 0,5ml là vắc-xin kết hợp có tác dụng phòng chống các bệnh: Ho gà – Bạch hầu – Uốn ván – Bại liệt – Viêm gan B – Các bệnh: viêm phổi, viêm màng não mủ do H.Influenzae tuýp B, được đăng ký lưu hành tại Việt Nam theo số QLVX-989-17 cấp ngày 27/3/2017 bởi Cục Quản lý Dược, Bộ Y tế.
Infanrix hexa 0,5ml được sản xuất bởi hãng Glaxo SmithKline (GSK) của Bỉ - một trong những công ty dẫn đầu về trong 3 lĩnh vực chính: Dược phẩm, Vắc Xin và Chăm sóc sức khỏe.
2. Quy cách đóng gói
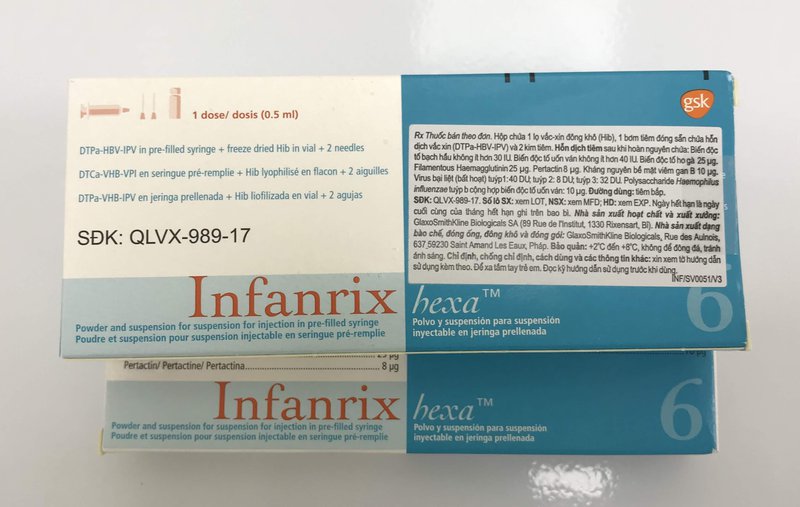
- Hộp chứa 1 bơm tiêm (DTPa-HBV-IPV), 2 kim tiêm và 1 lọ bột đông khô (Hib).
- Thành phần DTPa-HBV-IPV được đóng sẵn trong bơm tiêm. Thành phần Hib được đóng trong lọ thủy tinh.
- Lọ và bơm tiêm đóng sẵn. Lọ và bơm tiêm được làm từ thủy tinh trung tính loại I, tuân theo các tiêu chuẩn của Dược điển Châu Âu.
3. Dạng bào chế
Bột đông khô (Hib) và hỗn dịch (DTPa-HBV-IPV) để pha hỗn dịch tiêm .
4. Chỉ định
- Infantix hexa được chỉ định để tiêm chủng cơ bản và tiêm nhắc lại cho trẻ phòng ngừa bệnh bạch hầu, uốn ván, Ho gà, viêm gan B, bại liệt và Haemophilus influenzae tuýp b.
Liều lượng và cách dùng:
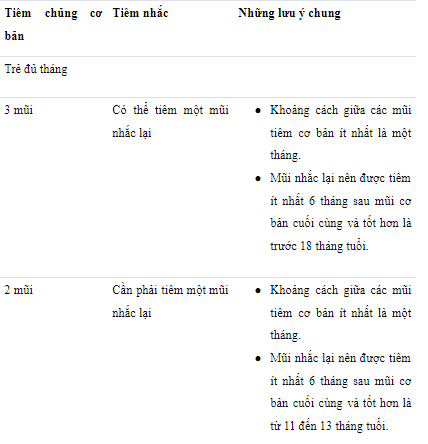
Lịch tiêm chủng cơ bản gồm hai hoặc ba mũi (0,5 ml) nên được áp dụng theo những khuyến cáo chính thức. Infantix hexa có thể xem xét để tiêm nhắc lại nếu thành phần kháng nguyên phù hợp với các khuyến cáo chính thức.

4. Chống chỉ định
- Quá mẫn với hoạt chất hoặc với bất kỳ tá dược hoặc chất tồn dư nào.
- Quá mẫn sau mũi tiêm vắc-xin bạch hầu, uốn ván, ho gà, viên gan B, bại liệt hoặc HiB trước đó.
- Chống chỉ định dùng Infantix hexa nếu trẻ có biểu hiện bệnh não không rõ nguyên nhân trong vòng 7 ngày sau tiêm chủng vắc-xin có chứa thành phần ho gà trước đó. Tron trường hợp này, nên ngừng tiêm vắc-xin ho gà và tiếp tục lịch tiêm chủng với vắc-xin bạch hầu-uốn ván, viêm gan B, bại liệt bất hoạt và Hib.
5. Cảnh báo và thận trọng đặc biệt
Giống như các vắc-xin khác, nên hoãn tiêm Infantix hexa cho các đối tượng đang sốt cao cấp tính. Không chống chỉ định khi có biểu hiện nhiễm khuẩn nhẹ.
Nên hỏi tiền sử y khoa trước khi tiêm chủng (nhất là việc tiêm chủng trước đó và khả năng có thể xảy ra các tác dụng ngoại ý) và kiểm tra lâm sàng.
Có thể không phải toàn bộ các trẻ được tiêm vắc-xin đều có đáp ứng miễn dịch bảo vệ.
Infantix hexa sẽ không ngăn ngừa được bệnh gây ra bởi các tác nhân khác ngoài Corynebacterium diphtheria, Clostridium tetani, Bordetella pertussis, virus viêm gan B, virus bại liệt hay Haemophilus influenza tuýp bộ. Tuy nhiên, người ta cho rằng viêm gan D có thể được ngăn ngừa bằng miễn dịch và viêm gan D (gây ra bởi tác nhân delta) không xảy ra trong trường hợp không nhiễm viêm gan B. Nếu bất kỳ biểu hiện nào dưới đây được biết là đã xảy ra trong khoảng thời gian tiêm chủng với vắc-xin ho gà, cần thận trọng khi quyết định sử dụng tiếp vắc-xin có chứa thành phần ho gà:
- Nhiệt độ 2 40,0°C trong vòng 48 giờ mà không phát hiện nguyên nhân nào khác;
- Suy sụp hoặc tình trạng giống shock (giai đoạn nhược trường - giảm đáp ứng) trong vòng 48 giờ sau tiêm chủng;
- Quấy khóc kéo dài dỗ không nín – 3 giờ, xuất hiện trong vòng 48 giờ sau tiêm chủng;
- Co giật kèm hoặc không kèm theo sốt, xuất hiện trong vòng 3 ngày sau tiêm chủng. Trong một vài trường hợp, như khi tỷ lệ mắc bệnh ho gà cao, thì lợi ích tiềm tàng là vượt trội các nguy cơ có thể xảy ra.
Ở những trẻ có các rối loạn thần kinh tiến triển, bao gồm các chứng co thắt ở trẻ nhũ nhi, động kinh không kiểm soát hoặc bệnh não tiến triển, tốt hơn nên hoãn tiêm vắc-xin ho gà (vô bào hoặc toàn tế bào) cho đến khi bệnh khỏi hoặc ổn định. Tuy nhiên, quyết định có tiêm phòng hay không cần tùy thuộc từng trường hợp cụ thể sau khi đã cân nhắc kỹ lưỡng về nguy cơ và lợi ích của việc tiêm phòng.
Cũng như tất cả các vắc-xin dạng tiêm, luôn có sẵn các biện pháp điều trị y tế và theo dõi thích hợp để phòng phản ứng phản vệ có thể xảy ra sau tiêm chủng, mặc dù rất hiếm.
Nên thận trọng khi tiêm Infantix hexa cho những đối tượng bị Giảm tiểu cầu hoặc rối loạn chảy máu vì có thể xảy ra hiện tượng chảy máu sau khi tiêm bắp cho những đối tượng này.
Không tiêm Infantix hexa vào tĩnh mạch hoặc trong da.
Không chống chỉ định dùng Infantix hexa khi có tiền sử co giật do sốt, tiền sử gia đình về co giật hay hội chứng tử vong đột ngột ở nhũ nhi (SIDS). Trẻ có tiền sử co giật do sốt nên được theo dõi chặt chẽ khi tiêm vắc-xin vì có thể xuất hiện tác dụng kh trong vòng 2 đến 3 ngày sau tiêm.
Dữ liệu từ các nghiên cứu lâm sàng cho thấy rằng khi Infantix hexa dùng cùng với chủng ngừa phế cầu khuẩn liên hợp, tỉ lệ phản ứng sốt xảy ra cao hơn so với sau khi tiêm Infanrix hexa đơn độc.
Báo cáo tỉ lệ co giật (có hoặc không có sốt) và đợt giảm đáp ứng trương lực (HHE) tăng lên đã được quan sát với việc sử dụng đồng thời Infantix hexa và Prevenar 13.
Điều trị hạ sốt nên được bắt đầu theo hướng dẫn điều trị tại mỗi nước. Ngất (xỉu) có thể xảy ra sau hoặc trước khi tiêm như một phản ứng tâm lý liên quan đến kim tiêm. Điều quan trọng là có những biện pháp để tránh bị Chấn thương do ngất.
6. Tác dụng không mong muốn
- Rất phổ biến (tỉ lệ ≥ 1/10): mất cảm giác ngon miệng, kích thích, quấy khóc bất thường, khó ngủ, đau, đỏ, sưng tại chỗ tiêm (≤ 50 mm), sốt ≥ 38oC, mệt mỏi.
- Phổ biến (tỉ lệ ≥ 1/100 và 39,5oC, sẩn cứng.
- Không phổ biến (tỉ lệ ≥ 1/1000 và
- Hiếm (tỉ lệ ≥ 1/10.000 và
- Rất hiếm (tỉ lệ

7. Hạn sử dụng
Hạn dùng: 36 tháng kể từ ngày sản xuất Hạn dùng của Vắc-xin được ghi trên nhãn và vỏ hộp.
Thận trọng đặc biệt khi bảo quản:
- Infantix hexa nên được bảo quản ở +2°C đến +8°c.
- Không để đông đá hỗn dịch DTPa-HBV-IPV và vắc-xin đã hoàn nguyên. Loại bỏ nếu vắc-xin bị đông đá.
- Tránh ánh sáng.
Nên tuân thủ khuyến cáo về điều kiện bảo quản vắc-xin trong quá trình vận chuyển. Nghiên cứu độ ổn định cho thấy các thành phần vắc-xin ổn định ở nhiệt độ lên tới 25 °C trong 72 tiếng. Dữ liệu này được dùng để hướng dẫn cho cán bộ y tế trong trường hợp chỉ tạm thời phơi nhiễm nhiệt độ.
Nguồn: Theo thông tin đã được Cục Quản lý Dược phê duyệt ngày 26/09/2017.
